1. Biomoléculas inorgánicas
1.1 El agua
Cuando los astrónomos buscan planetas donde pueda haber vida, buscan rastros de agua. El agua es fundamental para la vida tal cual la conocemos.
Sin ella, los seres vivos de nuestro planeta morirían. Sabemos que el agua cubre aproximadamente el 70% de nuestro
planeta y eso es solo en su estado líquido, hay más aún en forma de hielo y vapor.
Es la única sustancia que puede estar en los tres estados de agregación de la materia en la naturaleza. Esta sustancia constituye alrededor del 65 al 75% de la composición de un ser vivo.
Aunque se trata de una pequeña molécula, insípida e incolora, presenta propiedades únicas que la hacen insustituible para el mantenimiento de la vida en nuestro planeta.
Muchas de sus propiedades y características se deben a su estructura: dos átomos de hidrógeno unidos por una unión covalente (unión fuerte) a un átomo de oxígeno. Como los
1. La hipótesis actual postula que esto se debe a que todos los seres vivos provenimos del mismo antecesor común. Este tema lo abordaremos cuando veamos Evolución.
2. El término Biomoléculas puede referirse 1) solo las moléculas orgánicas como proteínas, lípidos, glúcidos y ácidos nucléicos, o bien, 2) referirse a todas las moléculas que están en los seres vivos:
biomoléculas orgánicas (proteínas, lípidos, glúcidos y ácidos nucléicos) y biomoléculas inorgánicas (agua y sales).
átomos de oxígeno e hidrógeno varían mucho en su electronegatividad, los electrones de los hidrógenos suelen estar más tiempo alrededor del núcleo del oxígeno, lo que genera una densidad de carga negativa cerca del núcleo del oxígeno, mientras que tendremos densidad de carga positiva alrededor de los átomos de hidrógeno.
Este desplazamiento de densidades de carga tiene como consecuencia que el agua sea una molécula polar, pues tiene dos polos –uno positivo y otro negativo– (ver Figura 1.1).
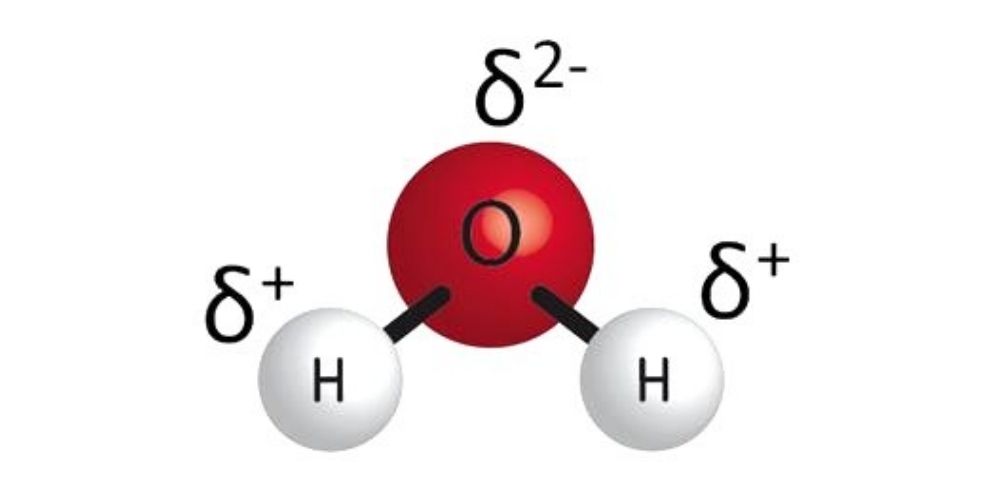
Figura 1. Esquema de la estructura de una molécula de agua y ubicación de las
densidades de carga en una molécula de agua.
Que el agua sea una molécula polar determina muchas de sus características como molécula y sus interacciones entre moléculas. A diferencia de una molécula apolar o no-polar, cuyas características estudiaremos más adelante en este mismo documento.
Las moléculas de agua forman uniones puente de hidrógeno entre sí. La polaridad de las moléculas de agua permite que interactúen entre sí, ya que las zonas con densidades negativas (ɗ-) de una molécula son atraídas por las zonas con densidades positivas (ɗ+) de otra molécula (Figura 2).
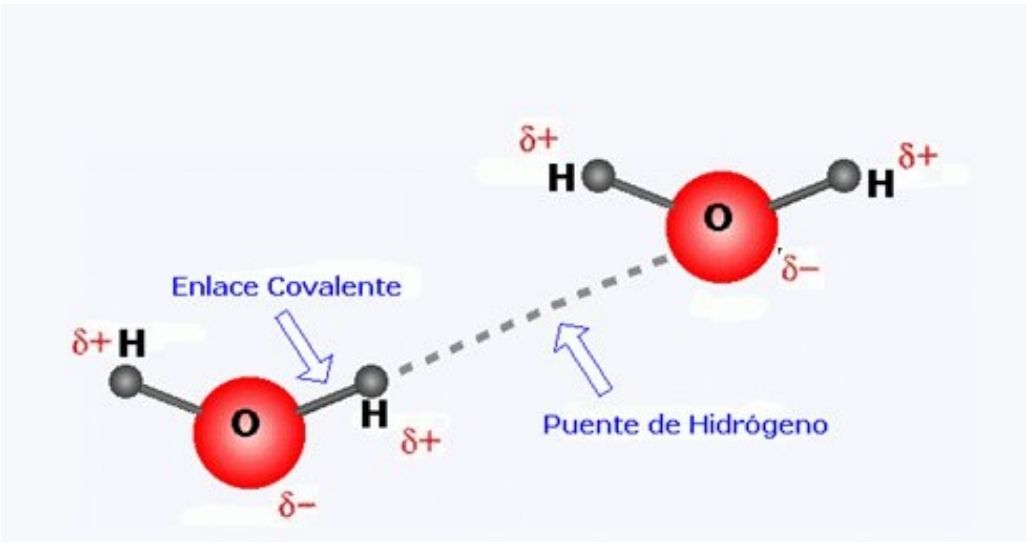
Figura 2. Esquema de dos moléculas de agua unidas por una unión puente de
hidrógeno.
La unión de tipo puente de hidrógeno es débil con respecto a las uniones covalentes; sin embargo, cada molécula de agua puede formar hasta cuatro puentes de hidrógeno con otras moléculas similares por lo cual se genera una estructura estable.
La estructura, su polaridad y su capacidad de interaccionar con otras moléculas le
confieren al agua características y propiedades emergentes³ que permiten que sea una sustancia única que hace posible la vida sobre la Tierra.
Tal como se observa en la Figura 3, las propiedades del agua que permiten la vida
incluyen:
• la cohesión entre moléculas,
• su capacidad de moderar la temperatura,
• su expansión al congelarse y
• su versatilidad como solvente.
En la naturaleza, las propiedades del agua permiten por ejemplo en el caso de la
cohesión, que ascienda el agua por el xilema (tejido especializado para ello) de los árboles, permitiendo que el agua llegue a cada una de las hojas.
Su capacidad como solvente universal
también permite, en el mismo ejemplo de las plantas, que las sales o nutrientes minerales vayan disueltas en el agua a todas las hojas.
Es esta misma fuerza de unión entre moléculas lo que produce que masas de agua no genere una variación abrupta de la temperatura de un ambiente.
También aumentan el calor que debiera absorber una masa de agua líquida antes
de evaporarse (lo que no sería igual si en vez de agua nuestras células estuviesen llenas de alcohol).
Además su bipolaridad le confiere su gran capacidad como solvente, ya que muchas
sustancias pueden solubilizarse en ella interactuando con sus densidades de carga positiva o negativa.
3. Propiedades que emergen de ese nivel de organización de la materia. Tiene las propiedades de sus componentes y nuevas que surgen de la interacción de las partes.
Ejemplo: los átomos de hidrógeno y oxígeno por separado no tienen las mismas propiedades que la molécula de agua ni que muchas moléculas de agua juntas que interactúan entre si.
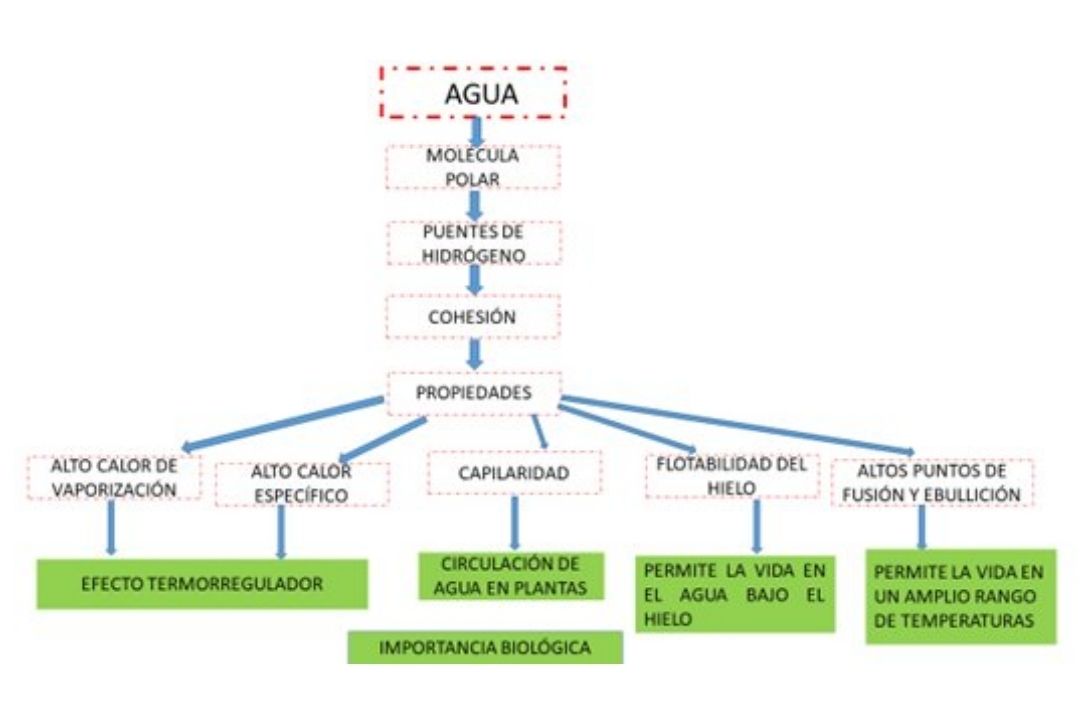
Figura 3. Diagrama de características del agua, sus propiedades e importancia biológica
Experiencia: Si quisiéramos probar la capacidad termorreguladora del agua, o sea que puede absorber grandes cantidades de calor sin evaporarse ni cambiar significativamente su
temperatura.
¿Cómo deberíamos hacer el experimento? Te proponemos una opción posible,
también hay otras.
Colocamos un recipiente de metal vacío (en realidad, lleno de aire) sobre el fuego, en pocos minutos aumentará mucho la temperatura, sin embargo, si dentro de ese mismo recipiente hay agua, dejándolo durante el mismo tiempo, apenas modificará la temperatura.
¿Por qué sucedió esto? No habrá gran variación de la temperatura, pues el agua
absorbe ese calor, amortiguando el cambio de temperatura. Ni el agua ni la olla aumentan mucho la temperatura con respecto a la inicial. A esto lo llamamos efecto termorregulador.
La capacidad del agua de ser solvente universal agrupa al resto de las moléculas en tres tipos, según su capacidad de ser disueltas en agua.
Las sustancias serán hidrofílicas (hidro,
agua; fílicas, afinidad) si pueden interactuar con el agua, hidrofóbicas si no se mezcla con agua o moléculas anfipáticas si dentro de la misma molécula posee regiones que pueden interactuar con el agua y otras regiones que rechazan al agua.
Así, todas aquellas moléculas polares con carga eléctrica (positiva o negativa) o aquellas que presenten un gran número de uniones covalentes polares, son hidrofílicas e interactúan con el agua.
Por el contrario, aquellas moléculas en las que predominan las uniones covalentes no polares, son hidrofóbicas y no interactúan con el agua no pudiendo solubilizarse; por lo tanto, se separan
de ella (ver Figura 4).
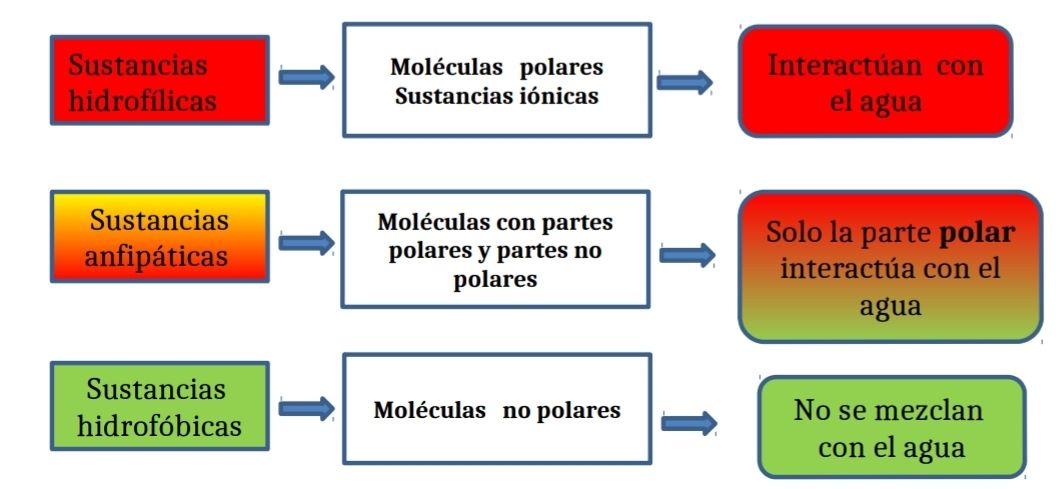
Figura 4. Cuadro de relaciones entre categorías, estructura y propiedades de las moléculas en relación con el agua.
Las moléculas anfipáticas se denominan así por tener un doble comportamiento frente al agua.
Los jabones y los detergentes -por ejemplo- se sirven de esta propiedad para “limpiar” o solubilizar el aceite, ya que establecen por un lado interacciones con el agua (mediante su región hidrofílica) y con el aceite (por medio de la región hidrofóbica).
En la Figura 5 puede observarse la interacción de las moléculas de agua con moléculas polares, con iones, y con moléculas anfipáticas.
En el diagrama se observa la formación de una micela, que es una estructura compleja con un interior hidrofóbico y una cubierta exterior hidrofílica.

Figura 5. Diagramas de interacción con el agua según la naturaleza de la molécula.
Los colores son similares a los de la Figura 4, donde el color rojo representa moléculas polares o hidrofílicas y el color verde representa moléculas apolares o hidrofóbicas.
Bạn đang đọc truyện trên: AzTruyen.Top