Le pH (ou potentiel hydrogènique)
Bonjour, chers lecteurs-élèves ! Aujourd'hui, pour cette leçon nous allons parler de quelque chose de simple, mais qui peut tout de même servir (eh oui ! Les cours, ça peut servir !) : le pH.
Alors, qu'est-ce que c'est que ça, me demanderez-vous ?
C'est bien simple. C'est ce qui nous permet de définir de l'acidité/basicité d'un produit.
En fait, la démarche est assez simple. On va utiliser du... papier pH ! Comme son nom l'indique, c'est une sorte de papier qui sert à mesurer le pH du liquide. Il suffit juste de tremper le papier dans le liquide, et il va se teinter, chaque teinte correspondant à un chiffre allant de 1 à 14 (précisons que le code couleur change selon le papier utilisé). Ensuite, il suffit d'analyser le code couleur pour connaître le pH du produit :
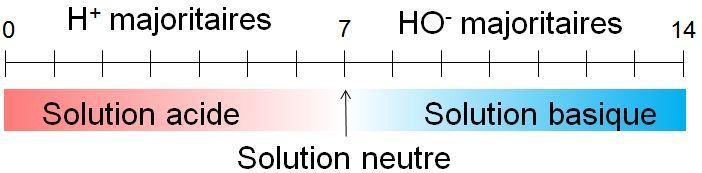
- pH < 7 = solution acide.
- pH > 7 = solution basique.
- pH = 7 = solution neutre.
Mais au fait, Jamy, pourquoi c'est comme ça ?
Et bien c'est assez simple. En fait, deux ions vont permettre de déterminer le pH. L'ion H+ et l'ion HO-. D'ailleurs, on peut noter que les deux sont des dérivés du H2O. Enfin bref, je disais : plus la solution possède d'ions H+, plus la solution sera acide, et vice-versa. Enfin, il faut préciser que si la solution possède le même nombre d'ions de chaque sorte, la solution sera neutre. C'est un peu comme une balance : d'un côté les ions H+, de l'autre les ions HO-. Plus j'en mets d'une certaine sorte, plus la balance penche de ce côté. S'il y en a autant, la balance reste immobile.
Bon, j'espère que ce petit cours vous aura été utile ! N'hésitez pas à poser des questions si vous avez besoin de précisions.
Bạn đang đọc truyện trên: AzTruyen.Top