La matière
Bonjour, asseyez-vous. Arrêtez de bavarder au fond !
Oh mince, c'est vrai, personne ne parle, je me suis trop emporté.
Bref, je suis le professeur Corblanc et ce chapitre portera sur la matière.
Pour commencer, qu'est-ce que la matière ? C'est ce qui compose chaque chose existant dans l'univers (il y a aussi l'antimatière, mais on en parlera pas maintenant).
La matière est donc composée de molécules.
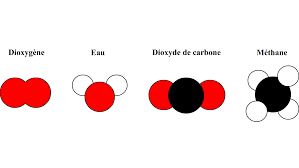
Ce sont un peu les "briques" de la matière.
On décrit ces molécules par leur formule chimique. Par exemple : l'eau est décrite H2O, ça signifie qu'elle possède deux atomes d'hydrogène (H2) et un atome d'oxygène (O). Tout le monde a compris ? Alors, on continue !
(Il ne faut pas placer les chiffres comme je l'ai fait mais en indice, c'est-à-dire en petit et en bas).
Dans les molécules, il y a les atomes !
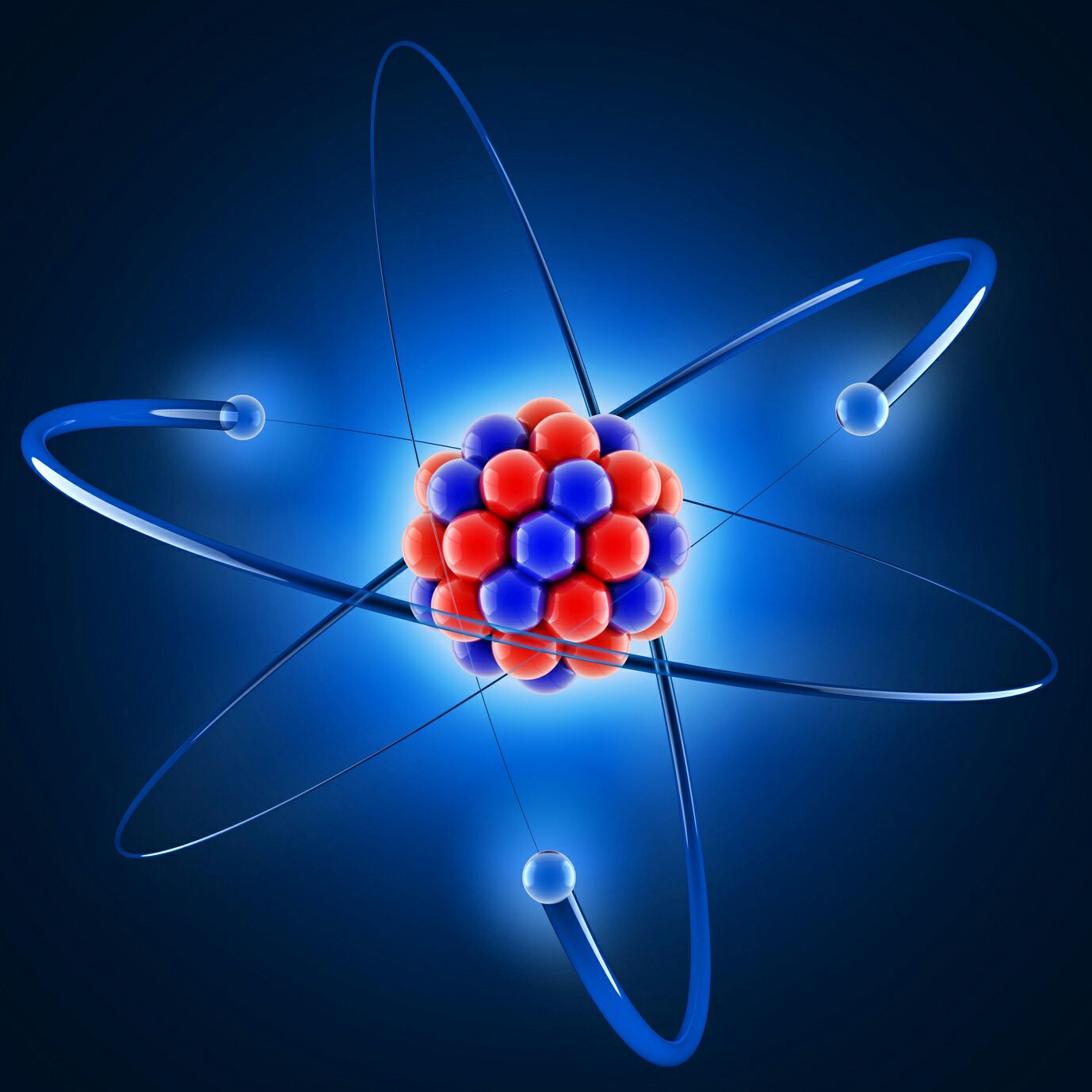
Bon, sachez que ce dessin n'est pas du tout réaliste.
Non, c'est plutôt ça.
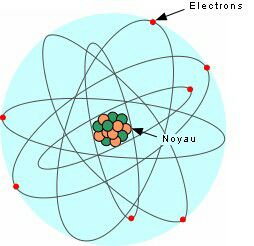
Même si c'est moins classe.
Bref. Dans un atome, il y a des neutrons, des protons, et des électrons.
L'atome est composé de deux parties. Le noyau, et le cortège électronique.
Le noyau est composé de protons et de neutrons qui se font appeler nucléons, et le cortège électronique, d'électrons.
Ils ont tous les trois, une charge électrique.
Le proton a une charge positive, l'électron, une charge négative et le neutron (comme le dit son nom), une charge neutre.
On peut considérer que les atomes sont lacunaires, ça veut dire qu'ils sont beaucoup composés de vide, car tout l'espace entre le noyau et le cortège électronique est vide. Un atome est composé d'environ 99 % de vide. Alors, on peut dire que la matière est lacunaire.
Un atome se caractérise par sa stabilité électrique, c'est-à-dire son nombre équivalent de charges positives (protons) et de charges négatives (électrons). Leur charge électrique globale est donc neutre.
Quelquefois, les atomes perdent ou gagnent un ou plusieurs électrons. Ils ne sont donc plus électriquement neutres et on les appelle les ions.
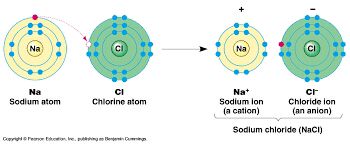
On les note comme ça : ion argent → Ag+
L'ion argent est marqué + : ça signifie qu'il lui manque 1 électron.
En effet, si on enlève une charge négative, l'ion est chargé positivement.
- = électron en plus (ion négatif ou anion).
+ = électron en moins (ion positif ou cation).
Ne confondez pas !
À présent, on va voir ce qu'il y a à l'intérieur de ces protons, neutrons, et électrons.
Les quarks !
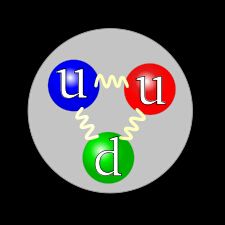
Ça dépasse largement les niveaux collège et lycée mais vous pourrez vous la péter ou grapiller quelques points pour un examen si besoin.
Bref, ce qui compose les nucléons et les électrons, ce sont les quarks.
Ce sont des petits grains raccrochés par de la "glue" atomique, les gluons (en jaune sur le schéma).
Il existe plusieurs sortes de quarks :
- Les quarks up et les quarks down qui donnent la charge électrique. Les protons ont 2 quarks up et un quark down, les électrons, deux quarks down et un quark up et les neutrons, un quark up et un quark down.
- Il y a aussi les quarks charm, strange, top et bottom. Mais n'en sachant pas plus, je me garderais de dire des bêtises.
Et bien voilà, la leçon est (enfin) terminée ! Vous avez pris des notes ? Ah non, c'est vrai, on n'est pas dans un vrai cours...
Bon, pas grave, voici un schéma explicatif !
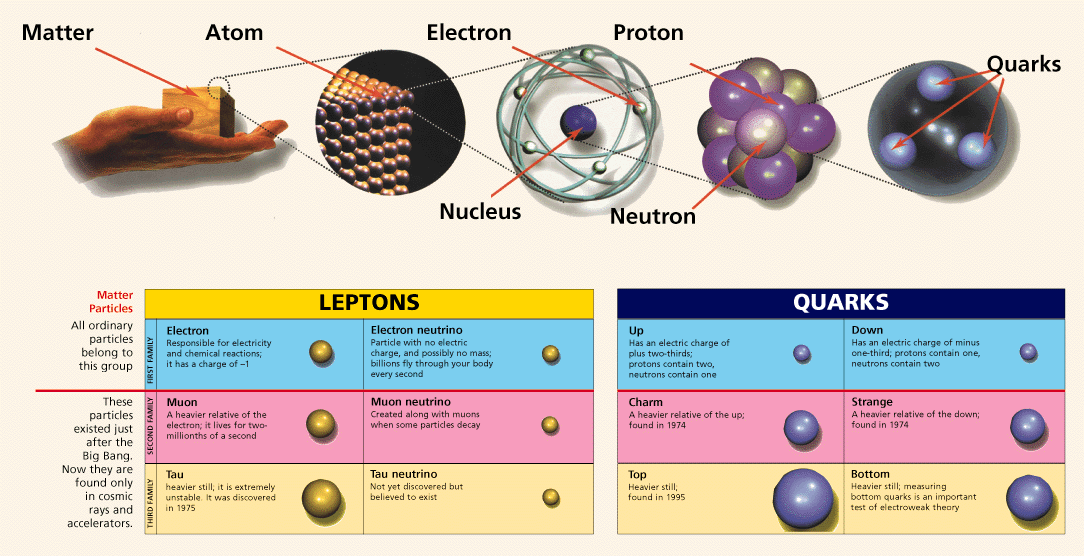
Merci de m'avoir écouté !
C'était le professeur Corblanc !
Bạn đang đọc truyện trên: AzTruyen.Top